
高一化学必修一知识点全部,高一化学必修一知识归纳
作者:admin发布时间:2021-02-27分类:综合资讯浏览:125评论:0
高一化学必修一知识归纳
《 必修1手册》的基本内容是从实验科学中选出的,化学和化学实验是安全的(进行有毒气体实验时,应在通风橱中进行,并应注意对废气的适当处理(吸收性或爆炸性等)进行易燃易爆气体实验应注意纯度,废气应燃烧或适当处理(烫伤应由医生处理(在实验室工作台上撒浓酸) ,先用(或)中和,然后用水冲洗,浓酸会粘在皮肤上,建议先用干布擦去,然后再用水冲洗,如果浓酸溅到眼睛上,请冲洗先用稀溶液,然后请医生治疗(将浓碱撒在实验室工作台上,先用稀乙酸中和,然后用水冲洗。如果浓碱在皮肤,建议先用大量水冲洗,然后再涂硼酸溶液。如果浓碱溅到眼睛上,请用水洗涤后再用硼酸溶液冲洗。 (钠,磷等,适用于火沙质土壤。增加了
高一数学必修1知识点归纳
个高中学习的难度,强度和能力,并且学习的负担和压力明显增加。您不能再依赖于“爬行”教学,初中教师的“监督”自学和“吸引”作业,逐步培养主动掌握常识,固定常识,制定学习计划,养成自主学习习惯的能力。以下是编辑器带给大家的高一化学必修个常识要点的摘要,希望我能对大家有所帮助!
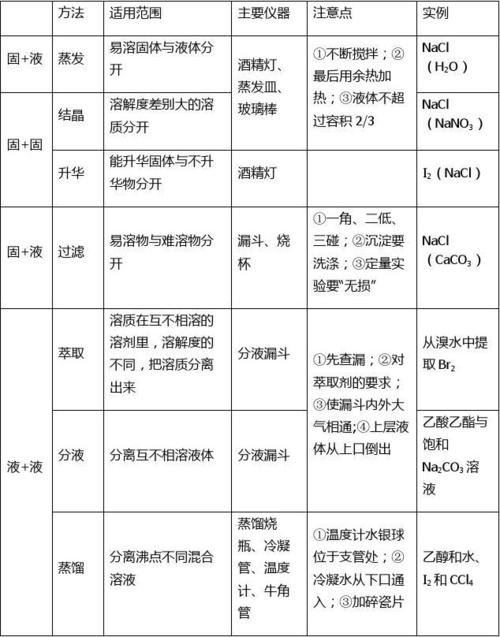
高一化学知识点总结全
高中化学具有很多需要记住的知识,例如化学方程式,化学实验,化学元素,为了使学生更方便地学习高中化学,高三网络的编辑编辑了高中化学的摘要必修,知识点,让我们来看一下,希望对您有所帮助。参加高中化学课程的高中生。
化学高中必修一知识点
高一化学在整个化学领域中占有非常重要的位置,并且是整个高中阶段最难的一点。因此,保持良好的学习态度和学习方法很重要。以下是高一化学个知识点的集合,希望对大家有所帮助。
高一物理必修一知识点梳理
.结晶硅是一种灰黑色固体,具有金属光泽,高熔点,高硬度,脆性,并且在室温下不活泼。晶体硅的导电性介于导体和绝缘体之间。它是一种很好的半导体材料,可以制成能源,例如光伏电池。硅化合物二氧化硅a,二氧化硅的物理性质有晶体和无定形两种。它具有高熔点和高硬度。 b。酸性氧化物的化学性质。酸酐,但不溶于水,是制造光纤的主要原料。石英用于制造石英玻璃,石英电子表,石英钟等;晶体通常用于制造电子工业,光学仪器,手工艺品等重要部件;石英砂通常用于玻璃和建筑材料。硅酸钠通常被称为硅酸钠,其水溶液通常被称为硅酸钠,其体积为.
人教版高一化学必修1
。 (单位L / mol物质体积气体体积/气体摩尔体积nV / Vm标准条件,Vm4L / mol化学实验中所用物质的量。所施加物质的浓度。(定义中使用溶质B的量为单位溶液体积代表溶液组成的物理量,称为溶质B的浓度。(单位mol / L(物质的量,溶质的量,溶液的体积,CBnB / V,量和某种物质的浓度(基本原理)根据要制备的溶液的体积以及溶质的量和浓度,使用计算相关物质的量和浓度的方法来找到所需溶质的质量或体积。用溶剂将溶质稀释至容器中的指定体积。准备溶液(主要操作a。检查是否漏水。b。准备溶液。
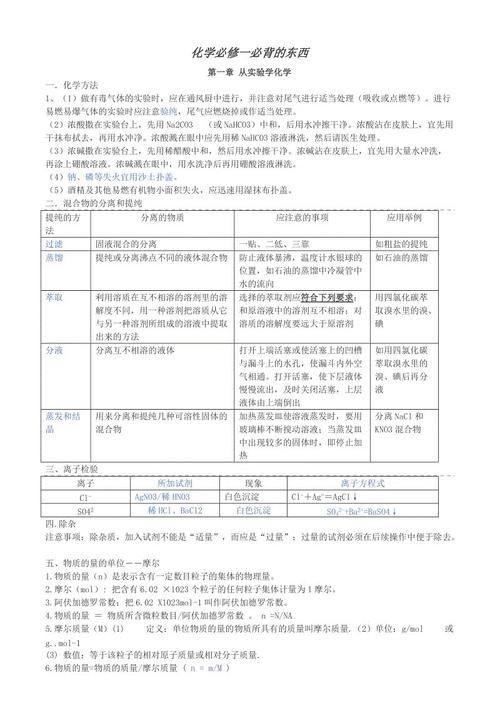
高一化学知识点归纳图
和常温下的非金属、、和酸)在一定的压力和压力下,铝遇浓硫酸或浓硝酸时会钝化,因此铝容器可用来盛放浓硫酸或浓硝酸c,大多数带有强碱金属偏铝酸钠的金属不会与碱反应,但铝会与d和铝热反应。铝具有很强的还原性,并且可以用酸和碱还原一些金属氧化物和铝化合物(它们是典型的两性氧化物a)。
高一化学必修一知识强清单
可与强碱(NaOH)反应,是一种酸性氧化物。在某些条件下,它可以与碱性氧化物反应。玻璃瓶不能用于在高温下包装HF。装有碱性溶液的试剂瓶应塞上软木塞或橡皮塞。硅酸()的酸度非常弱(比碳酸弱),并且溶解度非常低。由于SiO2不溶于水,因此硅酸是通过可溶性硅酸盐和其他比硅酸具有更强酸度的酸反应制得的。硅胶是多孔且疏松的,可以用作干燥剂和催化剂载体。硅酸盐硅酸盐是由硅,氧和金属元素组成的化合物的总称。它具有分布广泛,结构复杂,化学性质稳定的特点。一般不溶于水。 (,K.
化学必修一知识点总结初三下
胶体的胶体溶液类型可根据胶体颗粒与分散介质之间的亲和力分为亲液性胶体和疏液性胶体。当分散介质为水时,称为亲水性胶体和疏水性胶体。一定数量的亲水性胶体溶液到疏水性胶体罗液中,使胶体颗粒表面吸附一层亲水性
物质,通常有三种类型的识别,识别和推论,它们的共同点是:根据特殊性质
.根据物质的性质和特征反应,选择合适的试剂和方法,准确观察反应中明显的现象,如颜色变化,沉淀物的产生和溶解,气体的产生和气味,火焰的颜色等,以进行判断和解释。无色粘稠液体,常用作粘合剂,防腐剂和耐火材料。置于空气中会恶化。实验室可以使用可溶性硅酸盐与盐酸反应制备硅酸硅酸盐a,这是地壳岩石的主要成分。结构复杂,组成通常以氧化物形式表示。该表达比活性金属氧化物二氧化硅水更具有活性金属氧化物。例如,滑石可以表示为:硅酸盐工业介绍以含硅物质为原料,将硅酸盐产品加工成硅酸盐工业的行业主要包括陶瓷工业,水泥工业和玻璃工业,它们的反应包括复杂的物理和化学变化。 。水泥的原料是粘土和石灰石。玻璃的原料是纯碱石灰。
长期浓硝酸为黄色,因为它包含分解产生的NO2;工业浓盐酸为黄色,因为它含有Fe3 +。浓硝酸的储存方法是放在棕色的瓶子中,放在阴凉处。紫色石蕊溶液滴入浓硝酸中。硝酸现象首先变红,然后消失。稀硝酸滴落的现象意味着溶液只会变红。
种萃取剂原液彼此互不溶,溶解度不同:“萃取剂”是指萃取剂; “质量”是指溶质。这两个句子意味着在萃取操作实验中,选择萃取剂的原理是:萃取剂和溶液中的溶剂必须不混溶,溶质在萃取剂和原始溶剂中的溶解度必须不同(溶解度在萃取剂中的溶解度大于在原始溶液中的溶解度)。
可用于实验室生产氨(将干燥的铵盐和碱固体混合并加热)并通过向下空气法收集。用红色石蕊试纸检查收藏品是否已满。导电性,导热性,金属光泽,延展性,固态金属冶炼的一般原理(汞除外),热分解法适用于惰性金属(如Hg),银热还原法适用于活性较高的金属(如Fe,Sn,铅和其他电解方法适用于活性金属,例如K,Na,Al等。K,Ca,Na,Mg均为电解氯化物,Al为电解,铝及其化合物,铝的物理性质为银白色和柔软的固体,电气,热,韧性化学性质。
氯化铵热图像升华:这意味着当氯化铵晶体在试管中加热时,氯化铵会分解为氨气和氯化氢气体,并在喷嘴冷却时进行更新。结合产生氯化铵固体,这种现象就像表面上的升华,但本质上并不是升华。因为升华是物理变化,但是氯化铵在分解和结晶过程中会发生化学变化。
a和非金属,与水,酸,非氧化性酸和氧化性酸(如硝酸和浓硫酸)一起,被盐等氧化为三价铁,并进行测试Fe3离子溶液为浅绿色Fe2和KSCN溶液该效果未显示为红色,并且氯水的液滴变为红色。加入NaOH溶液显示白色灰色绿色红棕色,无色KSCN溶液显示红色Fe 3溶液显示黄色或棕色。加入NaOH溶液会产生红棕色沉淀的硅及其化合物,硅硅。它是一种亲氧性元素,在自然界总是与氧结合,并以高熔点的氧化物和硅酸盐的形式存在。有两种类型的硅,晶体硅和非晶硅。
O是一种弱酸,在溶液中主要以HClO分子的形式存在。它是一种具有强氧化性的弱酸,很容易分解并分解为HCl和O2,用于杀菌,消毒和漂白。漂白粉的膨胀次氯酸盐比次氯酸更稳定,更易于保存。在工业上,以Cl2和石灰乳为原料制备漂白粉。它的主要成分是和有效成分是它必须与空气中的酸或二氧化碳反应生成次氯酸,以发挥漂白作用。溴和碘的性质和用途。溴和碘的物理性质为深红棕色,比水致密,液体,强烈的刺激性气味,易挥发,极具腐蚀性的紫黑色固体,易升华。气态碘在空气中呈深紫红色,有刺激性气味,在水中几乎没有溶解性。易溶于有机溶剂,如乙醇和四氯化碳。化学性质。可以与氯反应的金属和非金属通常也可以与溴和碘反应。 。沿
方向发生的化学反应称为可逆反应,并通过可逆箭头符号连接。一氧化氮和二氧化氮在高温下自然形成,或在高温下排放N2O2或排放2NO。生成的一氧化氮非常不稳定。在室温下它将与氧气结合产生二氧化氮2NO2。简介无色气体是空气中的污染物。少量的NO可以治疗心血管疾病。二氧化氮的引入红褐色气体,刺激性气味,有毒,易液化,易溶于水,并与水反应。这是生产硝酸的工业方法。大气污染SONO2溶解在雨水中,形成酸雨。预防措施始于燃料燃烧。从立法管理开始。从能源利用和开发开始。从废气再循环开始,将危害转化为利润。 。
氧化铝与盐酸反应:+ 6hcl = + 3h2o氧化铝与氢氧化钠溶液反应:+ = + h2o氯化铁与氢氧化钠溶液反应:+ = fe(oh)3↓+硫酸亚铁和氢氧化钠钠溶液反应:+ = fe(oh)2↓+氢氧化亚铁被氧化为氢氧化铁:4fe(oh)2 + 2h2o + o2 = 4fe(oh)3
相关推荐
欢迎 你 发表评论:
- 综合资讯排行
- 最近发表
- 标签列表
-
